L'atome

Dans le monde dans lequel nous vivons, toute chose matérielle est constituée de particules infiniment petites. On appelle ces particules des atomes. Le bois est constitué d’atomes. Les métaux sont constitués d’atomes. L’eau est constituée d’atomes. Nous sommes nous-mêmes constitués d’atomes. De même que les végétaux, les roches, de même que le dioxygène que nous respirons et le dioxyde de carbone que nous expirons. Cette section a pour but d’en dire plus sur ces atomes.
Il n’est pas nécessaire d’acquérir l’ensemble des notions décrites dans cette section. Seule une partie d’entre elles permettent d’expliquer les principaux phénomènes qui régissent le rayonnement lumineux et l’électricité, les deux principales applications de la physique qui sont utilisées dans l’éclairage public. Toutefois, c’est en partant de ce qui se passe au niveau de l’atome que l’on peut décrire ce qui se passe quand la lumière se diffuse ou quand un courant électrique circule.
Je garde la même philosophie que celle que j’emploie pour l’ensemble de ce site web. Une présentation vulgarisée de la physique, des explications accessibles, des modèles simples. Afin de permettre à quiconque n’étant ni ingénieur, ni technicien, ni chercheur en physique ou en chimie d’intégrer les notions qui sont abordées sur cette section.
En première partie, je présente l’atome au niveau global, et notamment particules qui le constitue.
En deuxième partie, je montre le lien qui existe entre le positionnement des particules et l’énergie qu’elles transportent.
En troisième partie, je parle ce que l’on appelle le « principe d’exclusion », qui « autorise » et « interdit » des particules de se trouver ou non à un emplacement précis.
En quatrième partie, j’explique comment les atomes interagissent entre eux pour former des associations atomiques.
En cinquième partie, j’indique ce qui différencie les conducteurs et isolants électriques.
Sommaire
1 - Présentation de l’atome
1.1 - Protons, neutrons et électrons
1.2 - Des éléments électriquement neutres
1.3 - Les ions
1.4 - Le rôle des neutrons
2 - Positionnement des électrons et quantité d’énergie
2.1 - Des orbites associées à des quantités d’énergie
2.2 - Les niveaux d’énergie
2.3 - Les électrons libres
3 - Le principe d’exclusion de Pauli
3.1 - Des places limitées
3.2 - Des sous-couches
3.3 - Des orbites orientées
3.4 - Le spin
3.5 - Le principe d’exclusion de Pauli et ses conséquences
4 - Les associations atomiques
4.1 - Des interactions stabilisantes
4.2 - La couche de valence d’un atome
4.3 - Liaisons covalentes, ioniques et métalliques
5 - Les bandes d’énergie
5.1 - Démultiplication des niveaux énergétiques
5.2 - La théorie des bandes
5.3 - Bande de valence, bande de conduction et bande interdite
5.4 - Conductivité des matériaux
6 - L'atome selon la mécanique quantique
Conclusion
Présentation de l’atome
Protons, neutrons et électrons
En 1911, le Néo-Zélandais Ernest Rutherford découvre qu’un atome est constitué d’un noyau. Le noyau est constitué des particules suivantes, immobiles :
Autour du noyau, gravitent :
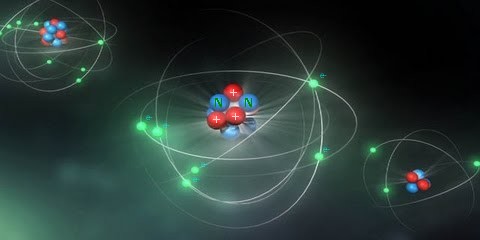
Le noyau est fixe dans l’atome. Les électrons sont des particules mobiles dans l'atome. Le modèle atomique de Bohr, présenté pour la première fois par le Danois Niels Bohr en 1913, représente un atome comme une sorte d’étoile miniature (le noyau) entouré de mini planètes (les électrons). Ce modèle est aujourd’hui obsolète, mais il reste le meilleur qui existe pour représenter de façon simple un atome. Ci-dessous la représentation simplifiée d’un atome selon le modèle de Bohr :

Le diamètre du noyau varie en fonction de l’atome, mais il est d’environ 10-15 mètres. Un atome s’étend quant à lui sur un diamètre d’environ 10-10 mètres. Aussi, il ne faut pas moins de 1021 atomes (mille milliards de milliards…) pour remplir un millimètre cube ! C'est-à-dire environ mille fois plus que le nombre de fourmis qui peuplent la Terre…
Le noyau pèse à lui tout seul plus de 99,9% de la masse totale de l’atome. Toutefois, en dimension, la place que prend le noyau dans l’atome équivaut à celle d’une bille d’un centimètre de diamètre dans une sphère d’un diamètre d’un kilomètre. Ou celle d’un grain de sable dans la Géode de la Villette si vous préférez… Autour du noyau se trouvent quelques électrons, puis… « rien ». Aussi, nous sommes nous-mêmes, humains, composés à 60% d’eau, elle-même, comme tout le reste, composée à plus de 99,99% de … « rien ».
Des éléments électriquement neutres
En physique, la « charge » est une propriété intrinsèque d’une particule électrique, au même titre qu’en mécanique, la « masse » est une propriété intrinsèque d’une structure matérielle. En mécanique, tout élément « pèse » un certain nombre de grammes, la masse est positive (une masse négative n’existe pas). Elle s’exprime en grammes. En électricité, la « charge » d’une particule est soit positive, soit nulle, soit négative. Elle s’exprime en coulombs.
Dans tout atome, on trouve autant de protons que d’électrons. Le nombre de « couples » protons et électrons varie en fonction de la nature de l’atome (ou du matériau qu’il constitue). Par exemple, dans un atome d’hydrogène, on trouve 1 proton et 1 électron. Dans un atome d’oxygène, on trouve 6 protons et 6 électrons. Aujourd’hui, on connaît des atomes allant de 1 et 118 « couples » de protons + électrons. Ils sont classés dans le « Tableau périodique des éléments », aussi appelé « Table de Mendeleïev ». Plus un atome contient de protons et d’électrons, plus le matériau qu’il constitue est « lourd ». Aussi :

Quel que soit le matériau, il y a toujours autant de protons que d’électrons dans un atome. Comme indiqué plus haut, un proton et un électron ont la même charge en valeur absolue (±1,602×10-19 coulombs). Un proton associé à un électron forme par conséquent un couple de charge nulle, dit « électriquement neutre ». Aussi, un atome, quel qu’il soit, est toujours électriquement neutre.
Un atome de Lithium
Un atome d'Uranium


Les ions
Nous le verrons dans les chapitres qui suivent, il arrive parfois que des électrons quittent un atome. Il arrive aussi que des électrons venant de l’extérieur intègrent un atome qui est initialement complet. Lorsqu’un atome se retrouve délesté d’un électron, il n’est plus électriquement neutre. Il en est de même si un électron rejoint un atome dans lequel se trouvaient autant d’électrons que de protons au préalable. On appelle ces nouvelles structures des « ions » :
Le rôle des neutrons
La physique obéit à une loi appelée « interaction électromagnétique ». Celle-ci implique que :
Répulsion
Répulsion
Attraction


C’est aussi bien valable pour deux charges élémentaires (les protons comme les électrons se repoussent entre eux, les électrons et les protons s’attirent) que pour les charges globales (les ions positifs comme les ions négatifs se repoussent entre eux, les ions positifs et négatifs s’attirent).
Au sein d’un atome, les neutrons permettent d’assurer la cohésion du noyau. Selon la loi d’interaction électromagnétique, tous les protons qui constituent le noyau se repoussent entre eux. Aussi, si on suit cette loi, le noyau, sous l’effet de répulsion mutuelle des protons qui le constituent, devrait voler en éclat. La présence de neutrons empêche le phénomène de se produire. La physique obéit à une autre loi, appelée « interaction forte ». Celle-ci est responsable du maintien de la cohésion des protons du noyau en présence de neutrons. L’interaction forte prend le pas sur l’interaction électromagnétique. Une vision des choses très grossière voudrait que les neutrons assurent un rôle de « super glue » entre les protons. La force de cette super glue étant bien plus importante que celle de répulsion des protons entre eux, le noyau reste ainsi en un seul bloc. Pour ceux qui souhaitent aller plus loin, la « théorie des quarks » tente d’expliquer de façon beaucoup plus précise les phénomènes qui se produisent à l’intérieur du noyau d’un atome.
Toujours selon la loi d’interaction électromagnétique, les électrons (qui gravitent autour du noyau) et les protons (au sein du noyau) s’attirent entre eux. Si on suit cette loi, les électrons devraient « s’écraser » sur le noyau pour rejoindre les protons. Les chapitres qui suivent expliquent pourquoi ce phénomène ne se produit jamais.
En résumé :
Positionnement des électrons et quantité d’énergie
Des orbites associées à des quantités d’énergie
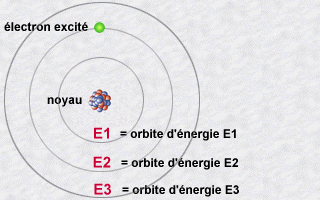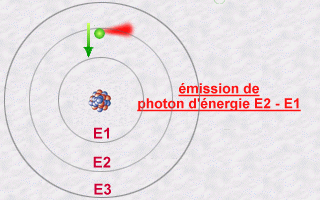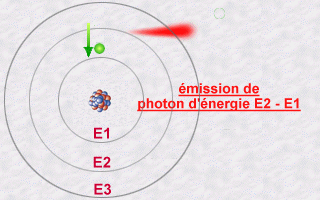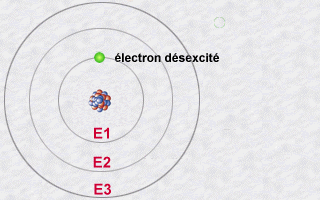
Lorsqu’une oie sauvage est au top de sa forme, elle dispose de l’énergie suffisante pour s’envoler le plus haut possible. Lorsqu’elle faiblit, elle n’a plus la force de voler et plane en direction de la surface. C’est en quelque sorte ce qui se passe aussi avec les électrons autour du noyau au sein d’un atome. Ceux-ci gravitent autour du noyau, mais à distance plus ou moins proche du noyau en fonction de leur niveau d’énergie. Ceux qui contiennent peu d’énergie gravitent en orbites proches du noyau. Ceux qui en contiennent plus gravitent en orbites plus éloignées.

Un électron « cherche » toujours à se trouver le plus proche possible du noyau (il est attiré par les protons du noyau). Les paragraphes qui suivent expliquent pourquoi il n’en a pas toujours la possibilité… Il arrive toutefois qu’un électron, qui gravite sur une orbite, « entre en collision » avec de l’énergie (transportée par un photon venant de l’extérieur). Lorsque cela se produit, l’électron capte ou emmagasine cette énergie et s’éloigne en conséquence du noyau vers une orbite supérieure. Lorsque, au contraire, un atome « réussit » à se rapprocher du noyau, il libère de l’énergie.
Cette « énergie dans la nature » qu’un électron capte ou libère est appelée un « photon ». On peut voir le photon comme une sorte de « paquet » d’énergie. La quantité d’énergie que ce « paquet » contient est variable. Quand un électron change d’orbite pour passer vers une orbite inférieure (se rapprocher du noyau), il libère une quantité d’énergie qui correspond à la différence d’énergie entre celle qui est associée à son orbite d’origine et celle qui est associée à son orbite de destination (orbite inférieure). Puisqu’en physique, « rien ne se gagne, rien ne se perd, tout se transforme », cette quantité d’énergie libérée se retrouve « dans la nature » sous forme de photon. On dit que l’électron « émet un photon ». Ce photon émis ira, dans un avenir plus ou moins proche, entrer en collision avec un autre électron. La section « Lumière » de ce site web en dit plus sur ces photons. Pour l’instant, retenons ceci :
Les niveaux d’énergie
On peut se demander pourquoi les électrons, chargés négativement, qui sont attirés par le noyau, chargé positivement, gravitent autour de celui-ci sans jamais le rejoindre. Après tout, nous avons vu que les charges négatives et positives s’attiraient mutuellement…
Bohr avança l’hypothèse suivante : les électrons ne peuvent occuper que certaines orbites définies au sein d’un atome. Autrement dit, les électrons peuvent se trouver à certaines distances du noyau, mais par n’importe lesquelles. Entre deux orbites, il existe ainsi toute une zone au sein de laquelle l’orbite d’un électron ne peut se trouver. Aucune orbite intermédiaire n’est possible.
Aussi, si à notre échelle on peut imaginer qu’un satellite peut graviter sur une infinité d’orbites (à une infinité de distances possibles) autour d’une planète, à l’échelle microscopique, un électron ne peut graviter qu’à un nombre limité d’orbites autour du noyau. On peut grossièrement parler d’orbites « autorisées » et d’orbites « interdites » autour du noyau.

Nous avons vu dans le paragraphe précédent que l’orbite empruntée par un électron dépendait de la quantité d’énergie qu’il transportait. Si un électron ne peut emprunter qu’une quantité limitée d’orbites autour du noyau, cela signifie qu’il ne peut pas transporter n’importe quelle quantité d’énergie. Aussi, les différentes orbites possibles qu’un électron peut emprunter autour d’un noyau sont aujourd’hui appelées les « niveaux d’énergie » d’un atome.
Les niveaux d’énergie les plus bas (les plus proches du noyau) sont appelées « couches » d’un atome. Les atomes connus aujourd’hui (classés dans le tableau périodique des éléments) comprennent un nombre d’électrons allant de 1 à 118. À l’état fondamental, ces électrons sont répartis sur un nombre de couches pouvant aller de 1 à 7. Plus il y a d’électrons dans un atome, plus il y a de couches :
Les couches d’un atome sont respectivement nommées « K », « L », « M », « N », « O », « P » et « Q », la couche « K » étant celle la plus proche du noyau.

Les électrons libres
Les électrons les plus difficiles à « déloger » de leur orbites sont ceux les plus proches du noyau, et ce pour deux principales raisons. D’une part, un électron « cherche » toujours à se trouver le plus proche possible du noyau (il est attiré par les protons du noyau). D’autre part, plus un électron est proche du noyau, plus son niveau d’énergie est bas. Plus son niveau d’énergie est bas, plus les niveaux d’énergie adjacents sont éloignés de celui où il se situe. En d’autres termes, si on se fie au modèle de Bohr, plus son orbite est basse, plus ses orbites voisines sont éloignées. Quand un électron est situé au premier niveau d’énergie (ou sur la couche K) autour du noyau, il faut lui fournir une quantité d’énergie importante pour que celui-ci effectue un saut au deuxième niveau (sur la couche L) ou à un niveau encore au-dessus. Cette énergie à fournir est moins importante pour qu’il effectue un saut du deuxième au troisième niveau, elle est encore moins importante pour qu’il effectue un saut du troisième au quatrième niveau, et ainsi de suite… Arrivé à un certain niveau (le cinquième, le sixième, le septième, le huitième, ou encore au-dessus…), les niveaux d’énergie deviennent tellement proches qu’ils forment un regroupement d’orbites proches d’un continuum.
Lorsqu’ils sont à très hauts niveaux d’énergie, les électrons passent ainsi très facilement d’un niveau d’énergie à un autre. On les appelle ainsi des « électrons libres ». Les électrons libres sont toujours associés au noyau d'un atome à un « instant t », mais à un niveau très éloigné.
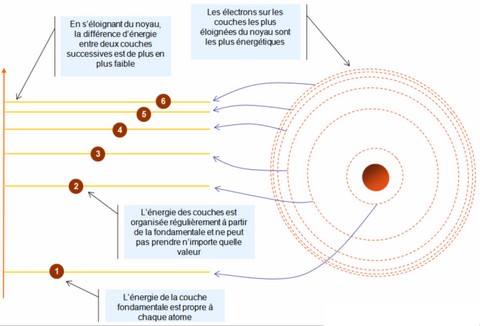
Nous le verrons lors du chapitre suivant, ce qui peut empêcher un électron de se rapprocher du noyau d’un atome est une « limitation des places disponibles ». En effet, seuls un nombre limité d’électrons peuvent se trouver proche du noyau d’un atome. Toutefois, lorsqu’un électron libre gravite à une distance éloignée du noyau d’un atome, un des deux phénomènes suivants peut se produire :
Au sein d’un solide, d’un liquide on d’un gaz, les électrons peuvent ainsi circuler d’atomes en atomes. Ce phénomène est à l’origine du « courant électrique » au sein d'un solide conducteur, il est (combiné à un « courant ionique ») à l’origine de « l’arc électrique » dans le cas d’un gaz.
Nota : On se limite souvent à représenter un atome comme une structure délimitée. Il n’existe ni « membrane » ni « frontière » qui délimiterait l’intérieur et l’extérieur d’un atome. Il existe théoriquement une infinité d’orbites en partant de la plus proche (niveau 1 ou couche K). Les couches d’un atome désignent les sept niveaux d’énergie les plus proches du noyau, sur lesquels se trouvent les électrons lorsque l’atome est dans son état « fondamental » ou « stabilisé ». Étant donné que l’on ne connaît pas d’atome comportant plus de 118 électrons à l’état fondamental, on ne connaît pas d’atome comportant un nombre de couches supérieur à 7.
Le principe d’exclusion de Pauli
Nous avons vu dans le chapitre précédent qu’un électron ne pouvait pas se trouver n’importe où. Nous allons voir au sein de ce chapitre que non seulement un électron ne peut pas se trouver n’importe où, mais qu’en plus au niveau même des emplacements autorisés, les places ne sont pas illimitées…
En 1925, Wolfgang Pauli propose une théorie appelée « principe d’exclusion ». Cette théorie explique comment deux électrons ne peuvent se trouver au même endroit… ou presque. On dit plus précisément que deux électrons ne peuvent être dans le même « état quantique » au sein d’un système… Nous allons voir un peu plus en détail au sein de ce chapitre en quoi cette théorie consiste précisément, et quelles sont ses conséquences.
Des places limitées
Nous avons vu au sein du chapitre précédent que les électrons ne pouvaient pas occuper n’importe quelle position au sein d’un atome. Seules quelques orbites définies sont possibles au sein d’un atome. Vient s’ajouter une nouvelle contrainte. Ces orbites sont comme des salles de concert, et on parle de concerts très courtisés… les places sont limitées. Elles sont même « très » limitées. Seule une quantité limitée d’électrons sont admis sur chacune des orbites autorisées autour d’un noyau. Sur une orbite n (où n = 1 pour l’orbite la plus proche du noyau, n = 2 pour la seconde orbite, n = 3 pour la troisième, etc…), le nombre d’électrons qui sont admis est égal à 2 × n2. Autrement dit :
Aussi, non seulement les électrons ne peuvent pas aller où ils veulent, mais en plus, ils ne peuvent pas se positionner sur une orbite existante si elle est déjà empruntée par un nombre maximal d’électrons... Autant dire que cela met de nombreux bâtons dans les roues de nos électrons dont le but est toujours d’être le plus près possible d’un noyau par lequel ils sont attirés. Le monde de la physique s’apparente à un concours entre électrons où le noyau d’un atome s’apparente à un graal qu’il est si difficile d’approcher. Les heureux gagnants sont rares…

Aussi, au sein d’un atome, les électrons sont répartis sur les différentes couches existantes. Les couches les plus proches du noyau sont généralement celles qui sont remplies en priorité, mais nous allons voir dans le paragraphe suivant que les choses ne sont pas aussi simples. Quoi qu’il en soit, à chaque atome est associée une configuration bien précise au niveau de ses couches. Par exemple :
Couches K, L et M d'un atome de mercure (Hg)

L'atome de mercure a la répartition d'Électrons par niveaux d'énergie suivante : 2, 8, 18, 32, 18, 2. Les quatre premières couches (K, L, M, N) sont dites saturées parce que le nombre d'électrons qui les empruntent dans l'atome est au maximum.
En physique, à chaque électron est associé un « nombre quantique principal » (appelé « n »). Il désigne la couche sur laquelle celui-ci est placé (n = 1 pour la couche K, n = 2 pour la couche L, n = 3 pour la couche M, etc…).
Des sous-couches
Nouvelle complexité. Chaque couche (ou niveau d’énergie) est divisée en sous-couches :
Les sous-couches sont organisées de la façon suivante :

Au sein d’un atome, les électrons remplissent en priorité les couches les plus basses. Par exemple, l'atome de sodium (noté « Na ») possède 11 électrons, dont 2 sur sa couche K, 8 sur sa couche L et 1 sur sa couche M (Électrons par niveaux d'énergie : 2, 8, 1).
S’il pourrait être simple d’imaginer que les électrons remplissent d’abord toute la couche « K », puis toute la couche « L », puis toute la couche « M », et ainsi de suite, les choses sont légèrement plus complexes. Aussi, par exemple, l'atome de mercure (Hg) possède 80 électrons, dont 2 sur sa couche K, 8 sur sa couche L et 18 sur sa couche M, 32 sur sa couche N, 18 sur sa couche O et 2 sur sa couche P (Électrons par niveaux d'énergie : 2, 8, 18, 32, 18, 2). On s’aperçoit que la quatrième couche (couche « N » qui peut contenir jusqu’à 50 électrons) n’est pas pleine, alors que certains électrons sont pourtant positionnés sur les 5ème et 6ème couche (couches « O » et « P »).
Le remplissage des couches et sous-couches remplit en fait un ordre bien précis, présenté ci-dessous (suivre les flèches), appelé « Règle de Klechkowski » :
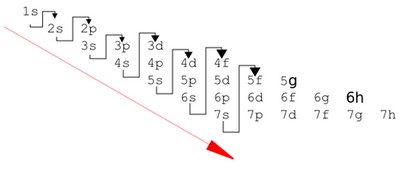
Aussi, par exemple, l'atome de mercure (Hg), possède 80 électrons, répartis par ordre de priorité sur les sous-couches suivantes :

En physique, à chaque électron est associé un « nombre quantique secondaire » (appelé « l ») qui désigne la sous-couche sur lequel celui-ci est placé (l = 0 pour la première sous-couche ou sous-couche « s », l = 1 pour la deuxième sous-couche ou sous-couche « p », l = 2 pour la troisième sous-couche ou sous-couche « d », etc…).
Des orbites orientées
Nouvelle complexité. Chaque sous-couche est divisée en orbitales. Si on se base toujours sur le modèle de Bohr, un atome forme ainsi un « système solaire miniature », qui comprend des électrons qui parcourent chacun une orbite circulaire, plus ou moins éloignée du noyau en fonction de leur niveau d'énergie (couche et sous-couche). Si on continue d'utiliser le modèle de Bohr pour visualiser un atome… les orbites correspondant à chaque sous-couche ne prendraient qu’un nombre limité d’inclinaisons (vue en 3 dimensions), appelées « orbitales » :
Les électrons de chaque sous-couche sont répartis sur les orbitales existantes au niveau de celles-ci :
On en arrive à la déduction que sur chaque orbitale, on ne peut trouver que 2 électrons maximum.
Orbitales sur une sous-couche « d »

Sur cette image, on peut voir les 5 orbitales (chacune empruntée par un unique électron) d'une sous-couche de type « d ».
En physique, à chaque électron est associé un « nombre quantique tertiaire » (appelé « m ») qui désigne l’orbitale sur laquelle celui-ci est placé :
Ainsi, autour d’un noyau, les électrons sont répartis sur des couches, elles-mêmes divisées en sous-couches, elles-mêmes divisées en orbitales. Une quatrième et dernière configuration permet de différencier les deux électrons qui peuvent être situés sur une même orbitale. Cette configuration en question s’appelle le « spin ».
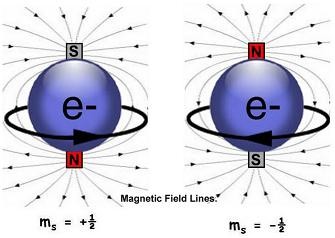
Le spin
Le spin est un état intrinsèque à une particule. Les êtres vivants savent et ont toujours su qu’en mécanique, un corps est doté d’une « masse » (positive). L’homme découvre au 18ème siècle qu’un corps est doté d’une « charge électrique », qui peut être positive ou négative. Il découvre dans les années 1920 qu’un corps est doté d’une nouvelle propriété, qu’ils baptisent le « spin », qui peut ou bien être considérée comme « up » ou bien comme « down ». Toutefois, contrairement à la charge électrique qui dépend de quoi une particule est « constituée », le spin dépend quant à lui de la façon dont une particule est « orientée ».
L’appellation de spin est issue du fait qu’à l’origine, les physiciens de l’époque voyaient les particules microscopiques (telles que l’électron, le proton, le photon…) comme des corpuscules sphériques qui tournaient sur eux-mêmes (« to spin » signifiant « effectuer un mouvement de rotation » en anglais). Nous pouvons garder cette représentation en tête si nous continuons à utiliser le modèle de Bohr. Sur son orbite autour du soleil, la Terre tourne sur elle-même, dans le sens antihoraire si nous sommes au-dessus du pôle nord, dans le sens horaire si nous sommes au-dessus du pôle sud. Le spin de l’électron est alors le sens de rotation de l’électron.

Contrairement à la charge qui est absolue (une particule électrique « est » de charge positive ou négative), le spin est relatif, puisque son sens de rotation dépend du point d'observation. Si au sein d'une pièce de monnaie, une particule effectue un mouvement de rotation horaire du côté pile, il effectue alors un mouvement de rotation antihoraire du côté face. Il n'y a ainsi pas de particules de « spin up » ou de « spin down » dans l’absolu. En revanche, on peut, comme pour la Terre, considérer que la particule comporte une face « nord » et une face « sud ». D'une manière générale, comme pour la Terre qui tourne sur elle même :
Nota : pour l'électron, qui est chargé négativement, c'est le contraire.
Au même titre que les couches, les sous-couches et les orbites, le spin de l’électron obéit à une règle énoncé par le principe d’exclusion de Pauli :
Cela suggère finalement qu’un atome est traversé par un axe central de symétrie, le long duquel le spin de chaque particule est aligné, soit dans un sens (« Up ») soit dans l’autre sens (« Down »). Cela ne veut pas obligatoirement dire que les axes de symétrie respectifs de chaque atome sont alignés dans un même matériau (la tendance peut se produire, notamment dans les matériaux aimantés).

En physique, à chaque électron est associé un « nombre quantique de spin » (appelé « s ») qui désigne si l'électron est de spin « Up » ou « Down » :
Nota : étant donné que les particules ne sont pas de spin « up » ou de spin « down » dans l'absolu, c'est par pure convention qu'on va choisir, pour un atome donné, quel groupe d'électron sera « up » et lequel sera « down » (de la même manière que c'est par pure convention que l'on a décidé un jour que c'était aux protons qu'on allait décider d'attribuer une charge « positive » et aux électrons une charge « négative », nous aurions tout à fait pu - et même peut-être du - faire le contraire). Mais finalement, le fait qu'un électron soit individuellement considéré comme de spin « up » ou « down » a peu d'importance en soi. Ce qui est vraiment essentiel, c'est de retenir que sur une seule et même orbitale, seul un « couple up et down » est possible.
Le principe d’exclusion de Pauli et ses conséquences
Le principe d’exclusion de Pauli aboutit ainsi à des structures atomiques parfaitement structures et organisées. Au sein d’un atome, les électrons sont répartis de la manière suivante :
Au sein d'un atome, chaque électron peut être individuellement désigné par un jeu de quatre nombres quantiques (principal, secondaire, tertiaire, spin), soit (n, l, m, s). Les trois premiers nombres donnent une indication sur le niveau d'énergie de l'électron, les différents niveaux d'une couche n étant découpés en sous-niveaux (sous-couches l) eux-mêmes découpés en sous-sous-niveaux (orbitalesm), le quatrième nombre sur son état de spin. Ce jeu de nombres désigne l'état quantique de l'électron.
Le principe d’exclusion de Pauli stipule que deux électrons ne sont jamais dans le même état quantique au même endroit. Concrètement, cela veut dire que deux électrons ne peuvent pas avoir le même niveau d'énergie, le même état de spin, au même endroit. Pourquoi ? Il n’y a pas d’explication. C’est ainsi que le monde microscopique fonctionne. Ce n’est tout simplement « pas possible », au même titre qu’au niveau macroscopique, deux êtres humains peuvent se percuter mais jamais se traverser.
Le principe d’exclusion de Pauli concerne un atome isolé, mais également un regroupement d'atomes, et même l'espace d'une manière générale. Il est impossible de trouver deux électrons ayant le même niveau d'énergie, le même état de spin, au même endroit, même s'il s'agit d'électrons d'atomes différents. Si nous avons, d’une part, une orbite A empruntée par deux électrons et, d’autre part, une orbite B, identique, empruntée par deux électrons, alors nous aurions des électrons dans le même état de spin qui « entreraient en collision ». C’est une situation qui est impossible selon principe d’exclusion de Pauli. On parle alors « d’interaction entre deux orbitales occupées » (donc interaction à 4 électrons). On dit que ces interactions sont de natures « déstabilisantes ».
Une interaction de nature « déstabilisante »

Dans le schéma ci-dessus sont représentées deux orbitales de deux atomes différents. Sur chaque orbitale, on trouve un électron en « Spin Up » (en bleu sur le schéma) et un électron en « Spin Down » (en vert sur le schéma). Les deux orbitales ne peuvent se croiser. Si c’était le cas, il y aurait une collision entre deux électrons en « Spin Up » d’une part, et une collision entre deux électrons en « Spin Down » d’autre part. Ce scénario est exclu selon le principe d’exclusion de Pauli.
Le principe d’exclusion de Pauli explique que les atomes, bien que principalement constitués de « rien », ne se traversent jamais. C’est la raison pour laquelle deux solides, formés d’atomes liés entre eux, ne se traversent jamais. C’est la raison pour laquelle, quand nous nous baignons, l’eau ne nous « pénètre » pas : les molécules d’eau (et de celles de l’air…) contournent celles des atomes qui nous constituent.
Les associations d’atomes
Des interactions stabilisantes
Lors des trois premiers chapitres, nous avons vu comment les choses étaient structurées au sein d’un atome isolé. Nous allons voir au cours de celui-ci comme ces atomes sont amenés à interagir entre eux, et à s’associer. Nous avons abordé en fin de chapitre précédent le cas de figure « d’interaction entre deux orbitales occupées » (interaction à 4 électrons). Nous avons vu que deux telles orbitales ne pouvaient « entrer en contact ». Une autre interaction est possible : « l’interaction à 2 électrons », soit :
Dans le premier cas de figure, les deux orbitales peuvent entrer en contact. Dans le second cas également, si les deux orbitales se croisent lorsque le spin de l’électron de l’une est « Up » et le spin de l’électron de l’autre est « Down ». Mieux : non seulement les deux orbitales vont se croiser, mais elles vont de plus se lier entre elles, pour former deux nouvelles orbitales « globales » et donner lieu à une « liaison covalente ». On dit que ces interactions sont de natures « stabilisantes ». Ainsi se forment les molécules. De telles associations se réalisent au niveau des électrons situés sur les couches les plus élevées des atomes, appelées « couches de valence ».
Une interaction de nature « stabilisante »
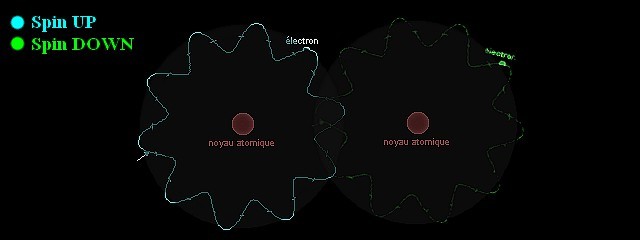
Dans le schéma ci-dessus sont représentées deux orbitales de deux atomes différents. Chaque orbitale est déjà respectivement occupé par un électron. Sur l’orbitale de gauche, on trouve un électron en « Spin Up » (en bleu sur le schéma). Sur l’orbitale de droite, on trouve électron en « Spin Down » (en vert sur le schéma). Les deux orbitales peuvent se croiser, car il est possible pour un électron en « Spin Up » de se retrouver au même endroit qu’un électron en « Spin Down ». Les deux orbitales vont même s’associer, de telle manière que les deux électrons ci-dessus seront « mis en commun » entre les deux atomes. C’est la formation d’une molécule.
La couche de valence d’un atome
Dans un atome, on appelle la « couche de valence » la couche la plus haute sur laquelle se trouvent des électrons. Par exemple :
On dit que la couche de valence d’un atome est pleine quand celle-ci est occupée par 8 électrons (sous-couches « s » et « p » remplies), à l’exception des atomes d’Hydrogène et d’Hélium qui n’intègrent que la couche « K » (2 électrons maximum) :
Un atome est de stabilité maximale quand sa couche de valence est pleine. Les atomes pour lesquels la couche de valence est pleine à l’état naturel correspondent à ce qui est appelé des « gaz nobles ». Parmi eux, on trouve le Néon, l’Argon, le Krypton ou encore le Xénon… Ces atomes, stables à l’état naturels, n’interagissent quasiment jamais avec d’autres atomes et sont peu soumis aux réactions chimiques. Quand la couche de valence d’un atome n’est pas pleine à l’état naturel, celui-ci va « tenter » d’aboutir à une couche de valence pleine. Généralement, les phénomènes suivant se produisent :
Je n’entrerais pas dans les détails concernant la formation de liaisons. Celles-ci relèvent principalement de la chimie. Voici toutefois l’essentiel concernant le principe de chaque liaison.
Liaisons covalentes, ioniques et métalliques
La liaison covalente
Dans le cas d’une « liaison covalente », des atomes mettent en commun certains de leurs électrons pour remplir leurs couches de valence respective. Ainsi, par exemple :
Il manque donc 1 électron à l’atome d’Hydrogène pour remplir sa couche de valence, et 2 électrons à l’atome d’Oxygène pour la remplir. Toutefois, si l’atome d’Oxygène « s’associe » avec deux atomes d’Hydrogène isolés :
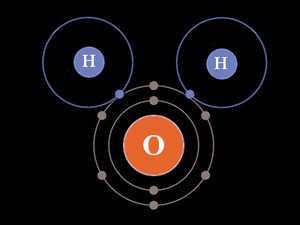
Ainsi, on aboutit à la formation d’une molécule qui intègre deux atomes d’Hydrogène et un atome d’Oxygène, soit une molécule d’eau. Elle est notée H2O.
Formation d’une molécule d’eau (H2O)

Voici une vision très grossière (en utilisant toujours le modèle de Bohr) au moment de la formation d’une molécule d’eau, avec :
Un atome d’Oxygène, constitué d’une couche « K » et d’une couche « L ». La couche « K » intègre une sous-couche « 1s », constituée d’une orbitale unique, sur laquelle gravitent 2 électrons de spin opposés. La couche « L » intègre d’une part une sous-couche « 2s », constituée d’une orbitale unique, sur laquelle gravitent 2 électrons de spin opposés. La couche « L » intègre d’autre part une sous-couche « 2p », constituée de trois orbitales. Sur la première gravitent deux électrons. Sur les deux autres, seul un électron est présent. Il y a donc deux orbitales au sein de l’atome d’Oxygène qui peuvent interagir avec des orbitales d’autres atomes.
Un atome d’Hydrogène, constitué d’une couche « K ». La couche « K » intègre une sous-couche « 1s », constituée d’une orbitale unique, sur laquelle gravite 1 électron.
L’orbitale unique de la couche K de chaque atome d’Hydrogène, d’une part, et les deux orbitales de l’atome d’Oxygène ne comprenant qu’un électron, d’autre part, peuvent s’associer pour former une paire d’électrons (de spin opposés). Cette association aboutit à une nouvelle structure moléculaire, selon une théorie nommée « LCAO » (Linear Combinaison of Atomic Orbitals).
La liaison ionique
Dans ce cas de figure, se produit une association entre :
Puisque les charges positives et négatives s’attirent entre elles, les cations et les anions s’attirent entre eux. Ainsi, par exemple :
Aussi, les ionisations respectives du Sodium et du Chlore se produisent fréquemment :
Aussi, les cations de Sodium (noté « Na+ ») et les anions de Chlore (noté « Cl- ») sont nombreux. Ceux-ci, puisqu’ils s’attirent, forment de manière très fréquente le composé chimique « Chlorure de sodium » (noté « NaCl »), qui n’est rien d’autre que du « sel ».

La liaison métallique
Le principe d’une liaison métallique est similaire à celui de la liaison covalente. Les deux principales différences sont les suivantes :
Lorsque le phénomène se produit à grande échelle, on aboutit à un solide métallique dans lequel les atomes sont principalement liés de par leurs nombreux électrons libres dont les orbitales se sont associées. Certaines « orbitales » ont un « diamètre » (en réalité un volume) qui englobe plusieurs atomes. Au final, au sein d’un solide métallique, on trouve :
Aussi, une liaison métallique est une liaison « hyper-délocalisée ». Cela revient à dire que chaque atome cède un ou plusieurs électrons à « l'ensemble du solide ». Une très grande quantité d’électrons libres sont mis en commun entre plusieurs milliards d'atomes.

Les bandes d’énergie
Nous avons vu dans les chapitres précédents que se produisaient les phénomènes suivants :
Démultiplication des niveaux énergétiques
Quand deux atomes se rapprochent (pour former une molécule ou un solide), les électrons des atomes respectifs subissent l’interaction avec le noyau voisin. Aussi, lorsque deux atomes se lient au sein d’un solide, un couplage entre les orbitales des deux atomes différents donne lieu à chaque niveau à la formation de 2 nouvelles orbitales : une « orbitale liante » et une « orbitale antiliante ». Celles-ci sont difficiles à schématiser sans sortir du modèle de Bohr. Toujours est-il que, pour chaque niveau :

L’exemple ci-dessous illustre les déformations des orbitales sur les sous-couches « 3s » (2 électrons pour 2 places) et « 3p » (2 électrons pour 6 places) de deux atomes de Silicium (donc identiques). À partir des deux niveaux d’énergie « 3s » et « 3p », on aboutit aux quatre niveaux d’énergie suivants, du plus bas au plus élevé :
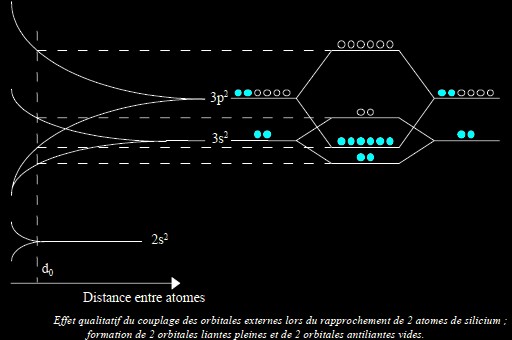
Le même phénomène se reproduit quand 2 couples d’atomes (4 atomes) interagissent. Il peut être décrit à grande échelle comme ceci :

Pour N atomes :
La théorie des bandes
La formation d’un solide métallique donne lieu à une démultiplication des niveaux énergétiques, en partant de celui de l'atome isolé, à partir des phénomènes de couplage d’orbitales expliqué dans le paragraphe précédent. On aboutit ainsi à une démultiplication des niveaux énergétiques correspondant à la sous-couche « 1s », puis « 2s », puis « 2p », puis « 3p », et ainsi de suite…

Ces niveaux démultipliés sont regroupés au sein de ce qu’on appelle des « bandes d’énergies ». Une bande d’énergie est un regroupement d’une très grande quantité de niveaux d’énergie. Ces niveaux sont si nombreux et rapprochés qu’on les représente comme un continuum entre un niveau d’énergie minimum et un niveau d’énergie maximum, qui délimitent la bande.
Parfois, il arrive que deux bandes associées à deux niveaux d’énergie de départ se recoupent. C’est d’ailleurs toujours ce qui se produit pour les bandes de haut niveau d’énergie, dans la mesure où, comme expliqué précédemment, au niveau d’un atome, plus les orbites sont hautes, plus leurs niveaux d'énergie sont rapprochés entre eux. Les changements de niveau d’énergie (ou déplacements d’électrons) sont d’autant plus fréquents que les bandes sont proches, puisque l’énergie à fournir aux électrons dans leur ensemble est moins importante pour les déplacer sur des orbites plus hautes.
Le positionnement et la largeur des bandes d’énergie varie en fonction de la nature des atomes et molécules qui constituent le solide, mais également de la température du matériau.
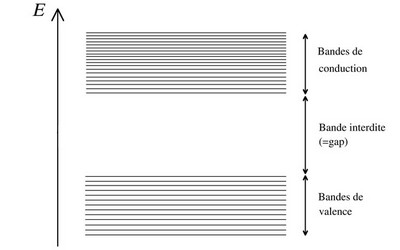
Bande de valence, bande de conduction et bande interdite
Sur l’ensemble des bandes d’énergies associées à un solide, deux d’entre elles influent grandement sur la conductivité (notée σ) des matériaux : la « bande de valence » et la « bande interdite » :
Entre le plus haut niveau de la bande de valence et le plus bas niveau de la bande de conduction, on trouve un « gap » plus ou moins large, également appelé la « bande interdite » (cette notion peut porter à confusion dans la mesure où la « bande interdite » n’est pas un regroupement de niveaux d’énergie mais une zone d’absence de niveaux d’énergie). C’est ce gap qui influe grandement sur la conductivité et résistivité des matériaux.
Conductivité des matériaux
Un courant électrique correspond à une circulation d’électrons d’atomes en atomes dans un solide conducteur. Elle est provoquée par une différence de potentiel électrique (se reporter sur la section « électricité » de ce site web pour plus d’informations). Pour qu’une circulation d’électrons d’atomes en atomes ait lieu au sein du matériau des électrons doivent pouvoir s’éloigner de leur noyau pour devenir électrons libres et ainsi se déplacer dans le solide. Ils doivent en conséquence acquérir de l’énergie.
Au même titre que les électrons ne peuvent pas transporter n’importe quel niveau d’énergie au sein d’un atome (ils ne peuvent que transporter une quantité d’énergie associée à un niveau d’énergie d’une sous-couche d’un atome), ils ne peuvent toujours pas transporter n’importe quel niveau d’énergie au niveau d’un solide. Seuls les niveaux d’énergie inclus dans les bandes d’énergie sont possibles.
Au sein d’un solide, la bande interdite inclut les niveaux d’énergie qu’un électron ne peut pas transporter, entre la bande de valence (niveaux d’énergie où les électrons sont sur la couche de valence de leur atome) et la bande de conduction (niveaux d’énergie à partir desquels les électrons sont électrons libres et participent à la circulation de courant). Plus cette bande est étroite, moins l’énergie qu’un électron doit acquérir pour passer de la bande de valence à la bande de conduction (où se trouvent les plus bas niveaux d’énergie qu’un électron peut transporter lorsqu’il est électron libre) est importante.
On distingue généralement trois types de matériaux :

Cette classification en trois catégories est avant toute chose une convention. Il n’existe pas de conducteur et d’isolant parfait. En réalité, l’ensemble des matériaux peuvent être placés dans une zone nuancée, située entre ces deux extrêmes. On donne une valeur de conductivité (notée σ) ou de résistivité (notée ρ, ce qui revient au même), avec σ = 1 / ρ, aux matériaux. Par exemple :
Nota : La conductivité est exprimée en « siemens par mètre », la résistivité est exprimée en « ohms par mètre ». On constate ainsi que le cuivre conduit… 5,85 × 1024 fois mieux que le verre… Aussi, il n’est pas aberrant d’appeler l’un « conducteur » et l’autre « isolant ».
Les conducteurs sont généralement utilisés dans les installations électriques. Les « fils électriques » sont constitués d’un conducteur en leur centre (généralement en cuivre), entouré par une gaine isolante protégeant les êtres vivant des électrisations et électrocutions. Les conducteurs permettent d’alimenter les appareils en leur fournissant du courant électrique.

Les semi-conducteurs sont généralement utilisés dans le domaine de l’électronique, qui consiste à traiter de l’information à partir d’un courant électrique. Les diodes et les transistors, dont la constitution comprend un semi-conducteur (généralement du silicium), permettent de réguler la quantité de courant que l’on souhaite faire passer en un point donné à un instant donné. Cette quantité de courant peut être ensuite convertie en une valeur chiffrée (« analogique » si on établit un lien direct entre la valeur mesurée et ce que l’on en fait, « numérique » si on fixe un seuil au-dessus duquel on détermine que le courant est synonyme d’un « 1 », en dessous duquel on détermine que le courant est synonyme d’un « 0 »).

L'atome selon la mécanique quantique
Pendant très longtemps, les physiciens ont pensé que le monde microscopique obéissait aux mêmes lois que notre monde macroscopique. C’est en effet ce qu’il y a de plus intuitif… Nous avions toutes les bonnes raisons de penser que l’infiniment petit ressemblait à notre monde, mais à une échelle miniature. Cette vision des choses, appelée « physique classique », a très longtemps perduré sans que personne n’y trouve à y redire. Il faut dire qu’au 17ème siècle, l’homme peinait encore à admettre que la Terre était ronde…
Les expériences et recherches se sont intensifiées au 19ème siècle. Plus l’homme avançait, plus il obtenait de résultats qui étaient de plus en plus difficiles à expliquer par la physique classique. Si le monde microscopique obéissait aux mêmes lois que le monde macroscopiques, alors il était « impossible » que certaines expériences aboutissent aux résultats que les chercheurs obtenaient. Et pourtant, ces résultats « étaient ». Certaines expériences, dont celles des « fentes de Young » et du « rayonnement du corps noir » ont abouti à l’avènement de la théorie de la physique quantique, au début du 20ème siècle.
Aujourd'hui, la modélisation qui consiste à représenter des « mini planètes » (les électrons) qui tournent autour d’un « mini soleil » (le noyau) est obsolète. Celle-ci a été imaginée par Niels Bohr en 1913, et présentait l’avantage de pouvoir illustrer un atome de façon simple. Raison pour laquelle je j’ai moi-même utilisée dans le cadre de cette présentation, raison pour laquelle elle est toujours couramment utilisée pour enseigner la physique à l’école. Cependant, ce modèle s’est très vite avéré limité pour expliquer de nombreuses découvertes faites au cours du 20ème siècle.

La théorie quantique donne une explication aux découvertes effectuées aujourd’hui. Son problème, c’est qu’elle est très difficile à imager, car les phénomènes qui se produisent à l’échelle microscopique n’ont pas d’équivalent à notre échelle. Nous sommes limités à ce que nos yeux nous permettent de voir. Je vais tout de même essayer de donner un aperçu du monde microscopique selon la théorie quantique. Il s’agit d’une théorie où :
